Aprobado por la EMA
Así es lecanemab, el nuevo fármaco contra el alzhéimer indicado para personas con deterioro cognitivo leve
El comité de expertos de la Agencia Europea del Medicamento (EMA) ha recomendado, finalmente, la aprobación este medicamento para personas que están en fases tempranas de enfermedad neurodegenerativa.
Unas 900.000 personas en España padecen alzhéimer, una enfermedad neurodegenerativa que produce un deterioro progresivo de las funciones cognitivas, alterando la capacidad funcional y produciendo una gran discapacidad y dependencia.
A día de hoy, el alzhéimer es un enfermedad que no tiene cura y el tratamiento consiste en, según cada caso y cada paciente, una combinación de terapias rehabilitadoras (indicadas en etapas leves y moderadas de la enfermedad y contribuyen a ralentizar el deterioro cognitivo y a preservan la autonomía de las actividad en la vida diaria) y terapias farmacológicas.
Con respecto a lo segundo, los fármacos disponibles hasta el momento son los inhibidores de la acetilcolinesterasa, indicados a mejorar la memoria y el aprendizaje a corto plazo y la memantina, un medicamento que, en general, mejora el desempeño de las actividad de la vida diaria.
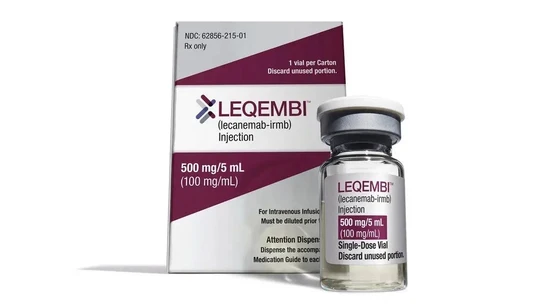
Sin embargo y a partir de ahora, existe un nuevo fármaco llamado lecanemab (Leqembi es su nombre comercial) que está indicado para fases iniciales de la enfermedad y que al fin, este pasado 14 de noviembre el Comité de Medicamentos de Uso Humano (CHMP) de la Agencia Europea del Medicamento (EMA) ha recomendado conceder la autorización para comercializarlo, tras una opinión negativa este pasado mes de julio.
Según informan desde la Fundación Pascal Maragall, esta recomendación "marca un hito en el tratamiento del Alzheimer" ya que este medicamento ha demostrado por primera vez, la capacidad de ralentizar la progresión de la enfermedad en un 27% al reducir las placas de proteína beta-amiloide en el cerebro, característica propia del Alzheimer. Este avance supone el inicio de un nuevo enfoque en la investigación e innovación para tratar la enfermedad de Alzhéimer.
"Estamos ante una noticia magnífica, ya que la aprobación de lecanemab no sólo supondrá que pacientes en etapas tempranas de la enfermedad pueden beneficiarse de este tratamiento, sino que también abre la puerta a otros fármacos innovadores y a un cambio profundo en la investigación, diagnóstico y tratamiento del Alzheimer que permita acabar con esta enfermedad", afirma el Dr. Arcadi Navarro, Director General de esta fundación.
El medicamento solo estará disponible a través de un programa de acceso controlado
Por su parte, desde la Sociedad Española de Neurología (SEN) explican que en la recomendación de la EMA sobre este medicamento, señala que "solo puede ser iniciado y supervisado por médicos expertos en el diagnóstico y tratamiento de la enfermedad de Alzheimer que dispongan de la tecnología suficiente- especialmente resonancias- para su correcto seguimiento".
Igualmente, de forma más concreta, informan que "su autorización de comercialización solo incluye a personas con solo una copia o ninguna de ApoE4 (una forma determinada del gen de la proteína apolipoproteína E)". De este modo, "el medicamento solo estará disponible a través de un programa de acceso controlado", explica la Dra. Raquel Sánchez del Valle, coordinadora del Grupo de Estudio de Conducta y Demencias de la SEN.
"La decisión de la EMA, se aproxima a la de otras agencias reguladoras y comités asesores y que permitirá a los pacientes europeos poder tener acceso a los mismos tratamientos que los pacientes de otros países como Estados Unidos, Reino Unido, Japón, China, etc.".
Tras 20 años sin novedades, en el último año, en EE.UU, Reino Unido, Japón, China, Israel o Emiratos Árabes Unidos, se han aprobado dos fármacos –uno de ellos es el lecanemab- dirigidos contra la proteína amiloide que "se acumula en el cerebro de los pacientes, que consiguen ralentizar el avance de esta patología en fases iniciales", añade el Dr. Jesús Porta-Etessam, presidente de la SEN.
Por lo que, "aunque estos medicamentos no permiten parar totalmente la progresión de la enfermedad, los resultados son modestos y no están exentos de efectos secundarios, es absolutamente fundamental que -aunque con las restricciones pertinentes- los pacientes europeos tengan acceso a los mismos tratamientos a los que pueden acceder otros pacientes de países de nuestro entorno", concluye el doctor.