El pasado viernes estaba previsto que Sanidad anunciase qué va a pasar con aquellas personas menores de 60 años que sólo han recibido la primera dosis de AstraZeneca. Al final han pospuesto la decisión de 4 a 6 semanas más.
Posponer la decisión significa que esta semana ya hay personas que han superado el tiempo indicado para completar la pauta vacunal. No se sabe qué pasará con ellos. Tampoco se sabe cuánto durará la protección de una sola dosis, ni cómo les afectará recibir la segunda más allá de las 4 a 12 semanas pautadas. No se sabe porque no se ha contemplado en los ensayos clínicos.
No hay ninguna razón científica que justifique dejar a estas personas en el limbo. El consenso científico es que debe completarse la pauta vacunal con AstraZeneca dentro del plazo estipulado. Así lo ha manifestado la Agencia Europea del Medicamento (EMA), la Organización Mundial de la Salud (OMS) y las 17 sociedades científicas que han remitido una petición al Ministerio de Sanidad.
La suspensión de la segunda dosis solo afecta a menores de 60
Las razones por las que Sanidad ha tomado la decisión de suspender la segunda dosis a menores de 60 años no se han explicado con claridad. La respuesta podría estar en el balance entre riesgos y beneficios y por el hecho de que afortunadamente hay más vacunas disponibles. El beneficio de la vacunación es mucho mayor para personas de más edad.
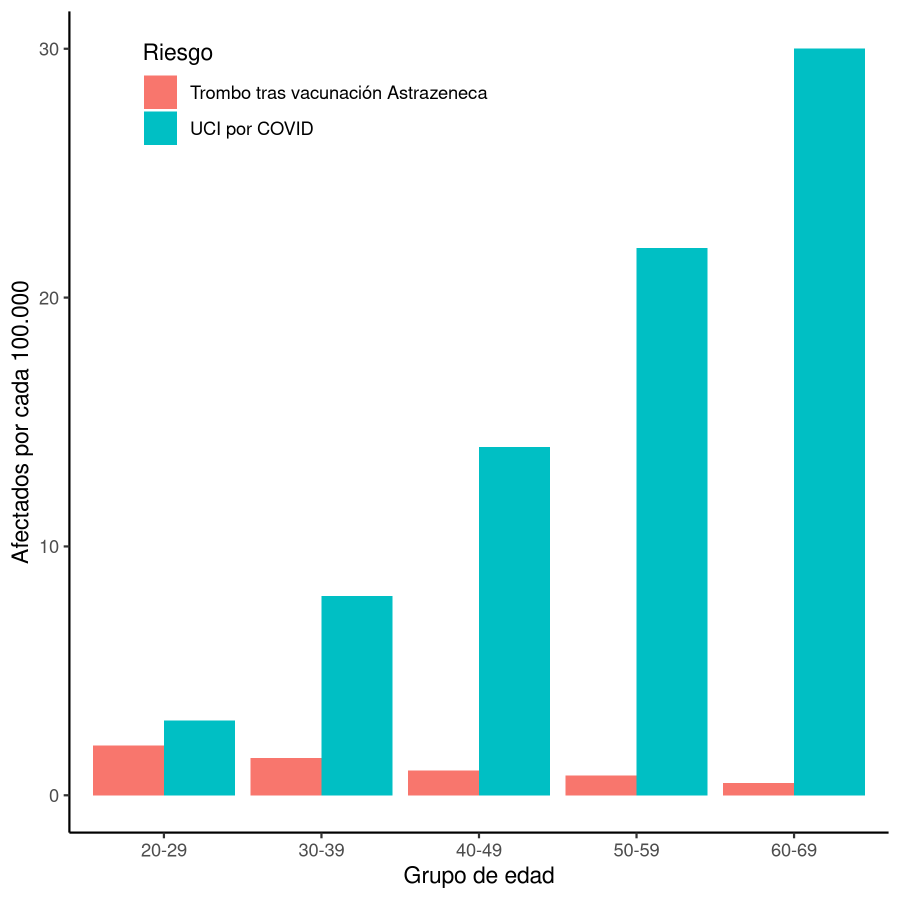
Comparando el riesgo de muerte y el riesgo de ingresar en UCI, tal y como figura en la gráfica, se ve claramente que el balance favorece a los mayores de 60. Son diferencias muy grandes. Sin embargo, para los más jóvenes los riesgos aparejados a la vacuna y a la infección parecen del mismo orden de magnitud. En todos los casos los beneficios de la vacuna superan a los riesgos, pero a más edad, esa diferencia es mucho mayor. Por eso parece lógico priorizar la vacunación con AstraZeneca de personas de más de 60 años.
Estos datos son aproximados, pero ayudan a entender los dilemas y los análisis de riesgo que hacen las autoridades sanitarias. Los cálculos precisos y las decisiones les corresponden a ellos.
A la espera del ensayo clínico para mezclar vacunas
Según Sanidad, la vacunación se ha detenido a la espera de los resultados del primer ensayo clínico autorizado por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) y promovido por el Instituto de Salud Carlos III que combina diferentes vacunas frente a la COVID-19: CombivacS. Esta investigación evaluará el efecto protector y la seguridad de la administración de una dosis de Pfizer en pacientes que ya hayan recibido una dosis de AstraZeneca una vez hayan transcurrido un mínimo de 8 semanas desde esa dosis.
Hasta ahora no existen datos clínicos del posible uso combinado de distintas vacunas, pero sí hay evidencias de que esta forma de abordar otras enfermedades es beneficiosa. Es un ensayo clínico en fase 2 en el que participarán 600 personas voluntarias y seleccionadas de forma aleatoria. La investigación comparará dos tratamientos en dos grupos de participantes: 400 personas recibirán una dosis de Pfizer, seguido de 28 días de observación; los 200 restantes no recibirán ninguna nueva dosis y se les realizará un seguimiento estrecho durante otros 28 días para observar el efecto de la vacuna recibida en su día.
Las dos vacunas que se mezclarán en el ensayo actúan con mecanismos de acción diferentes: la de Pfizer es una vacuna de ARN mensajero, mientras que la de AstraZeneca es una vacuna de vector viral no replicante de adenovirus.
La dosis de AstraZeneca ya confiere una importante inmunidad (80%), tanto humoral (anticuerpos) como celular. Con el ensayo se pretende comprobar si seguir otra pauta vacunal (con Pfizer) sirve como refuerzo o entrenamiento. La hipótesis es que en cuanto el ARNm de la vacuna de Pfizer desencadene la formación de proteína S, se verá si hay una respuesta inmunitaria rápida y fuerte, ya aprendida gracias a AstraZeneca.
Según la AEMPS, este ensayo busca continuar generando conocimiento sobre las vacunas frente a la COVID-19 y dar respuesta a aquellas personas menores de 60 años que ya han sido vacunadas con AstraZeneca y que no van a recibir la segunda dosis planificada. Hay varios ensayos similares en marcha, como el de la Universidad de Oxford, que servirán para dar más luz sobre este asunto.
Sin embargo, este ensayo tiene grandes limitaciones, por tiempo, porque no es doble ciego y porque es un ensayo clínico en fase 2. No servirá para aportar más información acerca de los efectos adversos raros o poco frecuentes. Tampoco servirá para evaluar cuál es la capacidad protectora de la mezcla a medio plazo, ni cómo protege de la enfermedad grave, ya que solo se medirá la producción de anticuerpos. La calidad de los resultados no puede compararse al trabajo ya hecho por farmacovigilancia ni a la de los ensayos clínicos que se han hecho con miles de personas tanto con Pfizer como con AstraZeneca.
Los resultados de CombivacS tardarán al menos 11 semanas más, con lo que la interrupción de la pauta vacunal afectará a más personas, por eso no se deben supeditar decisiones tan urgentes a sus resultados.
En ese caso el Ministerio de Sanidad ha anunciado que quienes han recibido una sola dosis de AstraZeneca y hayan superado las 12 semanas, recibirán una segunda dosis a las 16 semanas. Todavía no han anunciado de qué vacuna. Es una situación similar a la de Irlanda, en la que retrasaron la segunda dosis de AstraZeneca (pauta completa con la misma vacuna) fundamentándose en que en los ensayos clínicos con AstraZeneca hubo algunos participantes que recibieron la segunda dosis tras un periodo máximo de 16 semanas y la protección se mantuvo.
Aunque CombivacS es un ensayo con grandes limitaciones, es necesario. Este ensayo servirá para tomar decisiones en el caso de que, por el motivo que fuese, no hubiese dosis suficientes de AstraZeneca. El ensayo podría interpretarse como una preparación ante un escenario desgraciadamente posible: no disponer de vacunas de AstraZeneca.
Los efectos adversos no justifican la suspensión de la vacuna
La EMA anunció el 7 de abril que la posible asociación de la vacuna AstraZeneca con los casos de trombos es un efecto adverso "muy raro". "Muy raro" significa que, de haber relación causal (esto no se sabe aún), la probabilidad estaría por debajo de 1/100000 y así figurará en el prospecto. Farmacovigilancia ha registrado muy pocos casos: 86 en 25.000.000 dosis. La EMA mantiene que los beneficios superan con creces a los riesgos y que debe mantenerse la vacunación.

Como referencia, hay que recordar que los trombos asociados a COVID-19 grave afectan a 16/100. Así que podría decirse que las vacunas protegen indirectamente de los trombos.
Por eso los efectos adversos no justifican la suspensión de la vacuna, porque no vacunar causa muchas más muertes que vacunar. Claro que la responsabilidad de la muerte por acción es mayor que por inacción, como si una sola muerte producida por la vacuna tuviese más peso que las cientos de muertes de personas sin vacunar que se producen al día.
Posible explicación de los efectos adversos
Elmecanismo hipotético que se está investigando y que podría relacionar la vacuna con los eventos tromboembólicos consiste en una suerte de respuesta autoinmune.
Una de las respuestas que da el sistema inmunitario para combatir el coronavirus son los anticuerpos. Estos se acoplan a las proteínas que el virus tiene por fuera y los marca para su destrucción. Las vacunas inducen la formación de anticuerpos. La hipótesis más plausible es que las vacunas producirían anticuerpos que además de atacar a las proteínas del coronavirus, atacarían a otras proteínas. Esto sería una "respuesta autoinmune" porque los anticuerpos estarían atacando a proteínas propias. Hay unas proteínas que se encuentran en las plaquetas (factor plaquetario 4, PF4) que intervienen en la regulación de la coagulación sanguínea. Al atacar a estas proteínas, los anticuerpos producirían la activación anormal de las plaquetas, generando trombos. De momento es una hipótesis, pero si se confirma que el mecanismo es ese, la parte positiva es que tiene tratamiento.
Si no hay razones científicas para suspender la segunda dosis, ¿cuáles son?
Cuando se anunció el ensayo clínico de mezcla de vacunas CombivacS presumí que nos estábamos preparando para la posibilidad de no disponer de vacunas de AstraZeneca, por el motivo que fuese, y poder responder ante esa eventualidad si se diese el caso.
Sin embargo, la realidad es que actualmente sí disponemos de suficientes dosis como para que nadie se quede con la pauta vacunal a medias. Así que la razón no es la falta de suministro. Tiene que haber otras razones. Como no se han explicado más allá del cajón de sastre llamado "principio de precaución", solo puedo especular.
En algunos países se ha optado por administrar una primera dosis a cuantas más personas mejor, incluso a costa de retrasar la segunda. De esta manera se dota a más población de cierta protección, aunque no completa, al menos parcial. Esta podría ser una razón con criterio sanitario. También podría ser que se haya decidido administrar solo a mayores de 60, que es el grupo de más riesgo al que más beneficia esta vacuna, y dejar a los demás con la pauta incompleta, a sabiendas de que la eficacia del 80% de una sola dosis se mantiene al menos cuatro meses. Pero no lo sé. No lo sé porque no se ha dado esta explicación ni ninguna otra.
Nadie entiende nada, ni sabe lo que le espera, porque nadie explica nada. No encuentro razones científicas tras esta decisión. Si hay otras razones más allá de la ciencia, por favor que las expliquen con claridad y transparencia.